19.01.2026 à 16:25
La microscopie de fluorescence à super-résolution : véritable tournant technologique dans l’analyse de la dynamique des mitochondries
Pauline Teixeira, Docteur en biologie cellulaire, Université d’Angers
Arnaud Chevrollier, Professeur des Universités Biologie Médicale, Biotechnologie, Université d’Angers
Solenn Plouzennec, Doctorante, Université d’Angers
Texte intégral (1890 mots)
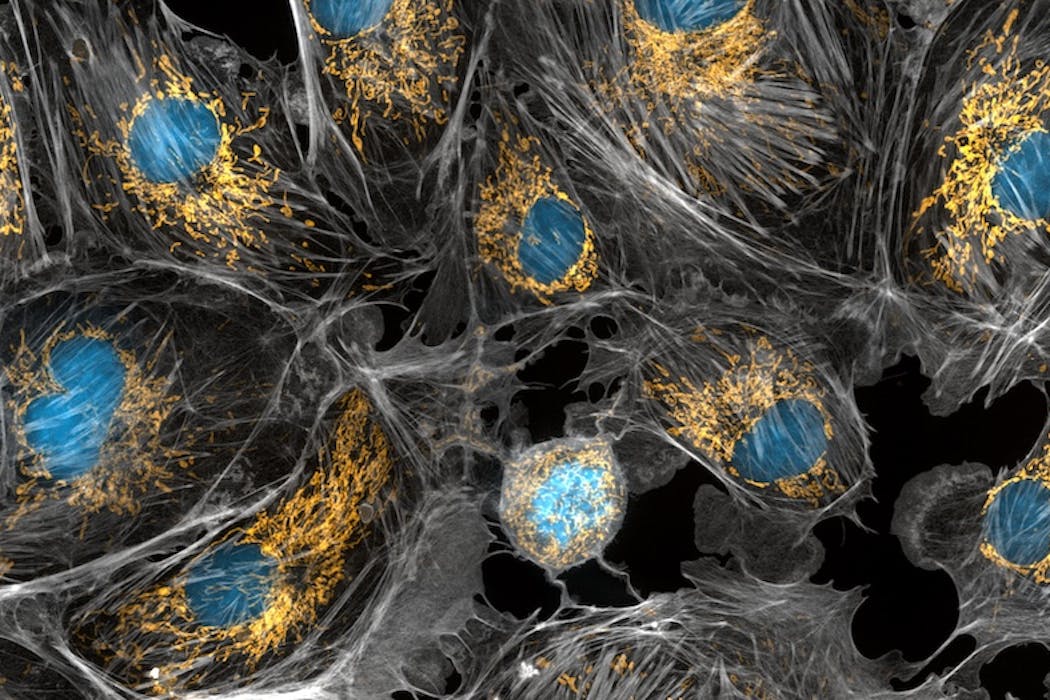
Explorer l’intérieur de nos cellules et leurs compartiments, tout en identifiant chaque protéine pour les cartographier, préciser leurs interactions et déchiffrer de nouveaux mécanismes biologiques… c’est désormais à notre portée grâce au développement de microscopes de super-résolution. Grâce à ces nouvelles techniques, les mitochondries, composants clés des cellules impliqués dans de nombreuses pathologies, révèlent une partie de leurs mystères.
Les mitochondries sont principalement connues pour être les centrales énergétiques de nos cellules, car elles y sont responsables de la production d’énergie et de chaleur. Elles participent également à la synthèse de nombreuses molécules et assurent un contrôle crucial sur la vie et la mort des cellules. Récemment, des microscopes ultrasophistiqués ont permis de mettre à jour l’incroyable vie active des mitochondries, qui se déplacent, fusionnent entre elles et se séparent.
Ces progrès sont cruciaux car les mitochondries sont impliquées dans de nombreuses atteintes neurodégénératives, maladies cardio-vasculaires et cancers. Comprendre comment les mitochondries endommagées contribuent au processus d’une maladie est essentiel pour le développement de traitements.
Les mitochondries, un réseau en reconfiguration perpétuelle
Dans la plupart des cellules et des tissus, les mitochondries ont la forme de tubes, plus ou moins longs. Les mitochondries s’adaptent à la taille et aux besoins énergétiques des cellules, ainsi dans les larges cellules énergivores, il peut y avoir plus de 200 000 mitochondries par cellules tandis que dans d’autres cellules, il y aurait moins de 100 mitochondries. En fonction de l’organe d’origine de la cellule, les mitochondries se répartissent dans la cellule et forment de grands réseaux. Elles changent également sans cesse de formes et leurs attachements avec les autres structures de la cellule.
Dès les années 1950, les données de microscopies électroniques ont révélé la structure de ces petits tubes et précisé leur organisation membranaire. Leur membrane externe est doublée d’une membrane interne, qui s’invagine et forme des poches à l’intérieur des mitochondries. Ces poches sont appelées crêtes et sont le lieu de la synthèse d’énergie.
Pour bien comprendre la fonction des mitochondries, il faut donc s’intéresser à leur structure, leur dynamique et leur distribution. Un axe important de travaux scientifiques porte sur cette relation structure-fonction afin de découvrir de nouveaux moyens de protéger la morphologie mitochondriale et de développer des stratégies thérapeutiques pour lutter contre les maladies mitochondriales ou les atteintes neurodégénératives.
La microscopie de fluorescence, la clé pour le suivi des mitochondries en temps réel
Si la microscopie électronique permet d’obtenir des vues extrêmement détaillées des mitochondries, son utilisation ne permet pas de rendre compte de la complexité de leur organisation au sein des cellules, ni de leur nature dynamique. En effet, ce type de microscopie se limite à des images cellulaires figées dans le temps. C’est ici qu’intervient la microscopie de fluorescence, un domaine en pleine effervescence qui permet de capturer des images ou des vidéos.
La microscopie de fluorescence repose sur le principe d’excitation et d’émission contrôlées de photons, particules composant la lumière, par des molécules présentes dans les cellules. Contrairement aux microscopes à fond clair, qui sont les microscopes les plus simples, comme ceux utilisés en cours de sciences, et où l’image est générée à partir des signaux collectés après le passage de la lumière à travers l’échantillon, les microscopes à fluorescence collectent les signaux lumineux qui proviennent de l’objet biologique lui-même, comme des petites ampoules que l’on allumerait au cœur de la cellule.
Le développement de l’informatique et des capteurs de caméra sensibles et rapides ont également rendu possible le suivi des signaux dans le temps, et la quantification des mouvements de chaque compartiment des mitochondries.
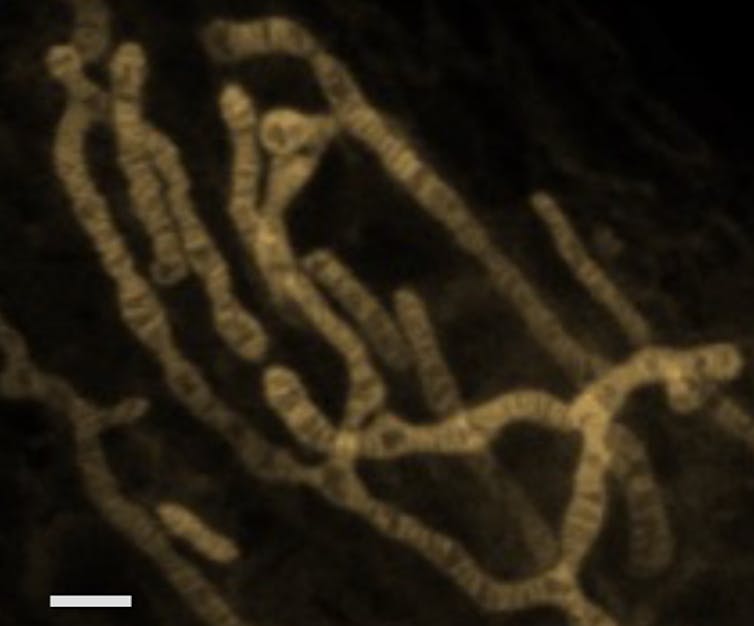
La super-résolution, quand la science éclaire l’invisible
Pour aller plus loin que ces observations déjà fascinantes de réseaux de mitochondries, la microscopie de fluorescence ne suffit pas. En effet, en microscopie optique, les objets plus petits qu’une certaine taille, environ 200-300 nanomètres radialement et 500-700 nanomètres axialement, ne peuvent pas être distingués. En effet, selon un principe physique, la diffraction de la lumière, soit la déviation des rayons lumineux, fait qu’un émetteur unique apparaît comme une tache sur la caméra – on parle de figure de diffraction, et plus précisément ici de « fonction d’étalement du point ».
Cette limitation entrave l’observation précise de structures complexes telles que les mitochondries du fait de leur taille qui est similaire à la limite de diffraction.
La microscopie de fluorescence à super-résolution (microSR) a changé la donne dans le domaine de la recherche biologique depuis les années 2000. Grâce à cette technologie, les scientifiques peuvent pénétrer dans le monde nanoscopique et observer en temps réel les structures complexes et les interactions des composants cellulaires. La microscopie de fluorescence à super-résolution englobe quatre techniques principales, dont l’une a été récompensée par le prix Nobel de chimie en 2014.
Chacune de ces techniques s’attaque à la limite de diffraction d’une manière unique, permettant de séparer des points situés à moins de 200 nanomètres. Cette avancée permet aux chercheurs d’atteindre des résolutions spatiales de quelques nanomètres, dévoilant ainsi les détails les plus fins des structures cellulaires comme jamais auparavant. Restreints il y a encore peu de temps à quelques laboratoires prestigieux dans le monde, ces équipements se démocratisent et se déploient dans les plates-formes de microscopie.
La mitochondrie sous un nouveau jour, dévoilée à l’échelle nanométrique
Nous avons utilisé un type de microscopie de fluorescence à super-résolution, la microscopie de localisation de molécules uniques, qui nous a permis d’identifier les protéines sur les membranes des mitochondries et de les cartographier.
Avec un autre type de microscopie de fluorescence à super-résolution, nous avons visualisé le contour des crêtes, retrouvant ainsi le visuel connu d’une image de microscopie électronique… à ceci près qu’aucun traitement chimique liée à la fixation de l’échantillon n’est venu perturber l’organisation de ces fines membranes et fragiles petites poches. Ceci permet de découvrir la complexité interne des mitochondries et l’hétérogénéité de ses structures, afin de corréler la morphologie des mitochondries à leur activité ou à la présence de défaut génétique.
Ces images donnent accès à deux échelles de temps, c’est-à-dire deux niveaux de cinétique. D’une part, sur quelques minutes durant lesquelles nous pouvons observer, nous voyons que les mitochondries se déplacent, changent de forme, fusionnent entre elles ou se séparent.
D’autre part, toujours avec la microscopie de super résolution, nous pouvons observer sur quelques secondes, toute l’ondulation et le remodelage des structures internes des mitochondries nécessaires à la production d’énergie.
Ainsi, on découvre que les mitochondries ne sont pas de simples centrales énergétiques cellulaires mais des organites dynamiques possédant de nombreuses particularités nanoscopiques. La microscopie de super résolution permet d’envisager une meilleure compréhension de comment les mitochondries endommagées contribuent au processus de nombreuses maladies, ce qui est essentiel pour le développement de traitements.
Arnaud Chevrollier a reçu des financements de l'Université d'Angers, AFM-téléthon
Pauline Teixeira et Solenn Plouzennec ne travaillent pas, ne conseillent pas, ne possèdent pas de parts, ne reçoivent pas de fonds d'une organisation qui pourrait tirer profit de cet article, et n'ont déclaré aucune autre affiliation que leur poste universitaire.
19.01.2026 à 16:06
L’origine du « moustique du métro de Londres » enfin résolue
Haoues Alout, chargé de recherche, Inrae
Texte intégral (1808 mots)
Longtemps présenté comme un exemple spectaculaire d’adaptation rapide à l’urbanisation, le « moustique du métro de Londres » n’est en réalité pas né dans les tunnels londoniens, comme on le pensait jusqu’ici. Une nouvelle étude retrace ses origines et montre qu’elles sont bien plus anciennes que ce que l’on imaginait. Elles remonteraient à plus de mille ans, en lien avec le développement des sociétés agricoles.
Et si le « moustique du métro de Londres », surtout connu pour ses piqûres sur les populations réfugiées à Londres dans les sous-sols de la ville pendant la Seconde Guerre mondiale, n’était en réalité pas né dans les tunnels londoniens ? C’est ce que révèle une étude que nous avons récemment publiée avec des collègues.

Nos résultats montrent que les caractéristiques « urbaines » de ce moustique, que l’on pensait s’être adapté à la vie souterraine il y a un peu plus d’un siècle, remontent en fait à plus de mille ans.
Le moustique Culex pipiens molestus, qui diffère de son cousin Culex pipiens pipiens dans la mesure où le premier pique surtout des humains, et le second surtout des oiseaux, est probablement né dans la vallée du Nil ou au Moyen-Orient, en lien avec le développement des premières sociétés agricoles humaines.
À lire aussi : Combien de temps un moustique peut-il survivre sans piquer un humain ?
Le « moustique du métro de Londres » n’est pas né dans le métro
Cette découverte jette une lumière nouvelle sur l’évolution des moustiques. Depuis plusieurs décennies, une hypothèse présentait en effet le moustique commun (Culex pipiens) comme un exemple spectaculaire d’adaptation rapide à l’urbanisation.
Selon cette théorie, une forme particulière de ce moustique, appelée Culex pipiens molestus, se serait adaptée à la vie urbaine en un peu plus de cent ans seulement, à partir de sa forme jumelle Culex pipiens pipiens. Là où celle-ci préfère piquer les oiseaux, s’accoupler dans des espaces ouverts et « hiberner » pendant l’hiver, la forme molestus aurait évolué en une forme quasi distincte, capable de vivre dans les souterrains et de piquer l’humain et d’autres mammifères, de s’accoupler dans des souterrains et de rester actif toute l’année.
Cette adaptation spectaculaire du « moustique du métro de Londres » était devenue un cas d’école, figurant dans de nombreux manuels d’écologie et d’évolution. L’idée sous-jacente était que l’urbanisation des villes pouvait sélectionner à grande vitesse de nouvelles espèces et en quelque sorte « accélérer » l’évolution.
Mais notre étude vient montrer que cette belle histoire, aussi séduisante soit-elle, est fausse.
Un moustique urbain… né bien avant les villes modernes
Notre consortium international de chercheurs PipPop a ainsi publié dans la revue Science une étude qui démystifie cette hypothèse. En séquençant le génome de plus de 350 moustiques, contemporains et historiques, issus de 77 populations d’Europe, d’Afrique du Nord et d’Asie occidentale, nous avons reconstitué leur histoire évolutive.
En définitive, les caractéristiques qui font de Culex pipiens molestus un moustique si adapté à la vie urbaine ne sont pas apparues dans le métro londonien, mais bien plus tôt, il y a plus de mille ans, vraisemblablement dans la vallée du Nil ou au Moyen-Orient. Ce résultat remet en question ce qui était considéré comme un exemple clé de l’évolution urbaine rapide. Au final, il s’agirait d’une adaptation plus lente, associée au développement de sociétés humaines anciennes.
Autrement dit, ce moustique était déjà « urbain » (au sens : étroitement associé aux humains) bien avant l’ère industrielle. Les premières sociétés agricoles, avec leurs villages denses, leurs systèmes d’irrigation et leurs réserves d’eau, lui ont offert un terrain de jeu idéal pour son adaptation.
À lire aussi : Comment les moustiques nous piquent (et les conséquences)
Un acteur clé des épidémies modernes
Le moustique Culex pipiens n’est pas juste une curiosité scientifique : il joue un rôle majeur dans la transmission de virus comme ceux du Nil occidental ou d’Usutu. Ces derniers circulent surtout chez les oiseaux mais peuvent aussi être transmis aux humains et aux mammifères.
La forme Culex pipiens pipiens, qui pique les oiseaux, est principalement responsable de la transmission du virus dans l’avifaune, tandis que Culex pipiens molestus est vu comme responsable de la transmission aux humains et aux mammifères.
Lorsque les deux se croisent et s’hybrident, ils pourraient donner naissance à des moustiques au régime mixte, capables de « faire le pont » entre oiseaux et humains et de nous transmettre des virus dits zoonotiques.
De fait, nos analyses confirment que les deux formes s’hybrident davantage dans les villes densément peuplées, augmentant le risque de transmission de ces virus. Autrement dit la densité humaine augmente les occasions de rencontre entre les deux formes de moustiques – et potentiellement la probabilité de produire des moustiques capables de piquer à la fois les oiseaux et les humains.
Comprendre quand et où ces deux formes se croisent et comment leurs gènes se mélangent est donc crucial pour anticiper les risques d’épidémie.
Repenser l’adaptation urbaine
L’histoire du « moustique du métro de Londres » a eu un immense succès parce qu’elle incarne en une image frappante tout ce que l’on redoute et admire dans l’adaptation rapide des espèces à nos environnements. Par exemple, une adaptation très rapide face à l’augmentation de la pollution et de l’artificialisation des habitats, souvent mobilisée dans les imaginaires, de science-fiction en particulier.
Mais la réalité est tout autre : les moustiques de nos villes modernes ne sont pas une nouveauté née dans le métro londonien. En revanche, le développement urbain a offert une nouvelle scène à un acteur déjà préparé par des millénaires de cohabitation avec les humains dans les premières sociétés agricoles du Moyen-Orient et de la Méditerranée. Le fruit de cette évolution a ensuite pu être « recyclé » dans les villes contemporaines.
On parle alors d’ « exaptation », c’est-à-dire qu’un trait préexistant dans un contexte donné (ici les premières villes du Moyen-Orient) devient avantageux dans un autre contexte (les villes du nord de l’Europe). Les circuits sensoriels et métaboliques qui pilotent la recherche d’hôtes à piquer, la prise de repas sanguin et la reproduction avaient déjà été remodelés par l’histoire ancienne des sociétés agricoles de la Méditerranée et du Moyen-Orient, avant d’être « réutilisés » dans le contexte urbain moderne au nord de l’Europe.
Nos systèmes d’irrigation antiques, nos premières villes et nos habitudes de stockage de l’eau ont donc posé les bases génétiques qui permettent aujourd’hui à certains moustiques de prospérer dans les galeries de métro ou les sous-sols d’immeubles de nos grandes villes.
Cette découverte change la donne. En retraçant l’histoire de la forme urbaine du moustique commun Culex pipiens, l’étude invite à changer de regard sur l’évolution urbaine : ce n’est pas seulement une adaptation rapide déclenchée par l’urbanisation intensive des villes, mais un long processus qui relie notre développement technique et social et celle des autres espèces.
Comprendre ces dynamiques est crucial : non seulement pour la science, mais aussi pour anticiper les risques sanitaires et mieux cohabiter avec les autres espèces. Et vous, saviez-vous que le moustique qui vous pique la nuit avait une histoire évolutive aussi ancienne ?
Haoues Alout a reçu des financements de l'ANR et de l'ANSES ainsi que de l'Union Européenne.
18.01.2026 à 20:51
Les plantes aussi ont un microbiote – pourrait-on s’en servir pour se passer de phytosanitaires ?
Cécile Monard, Chargée de recherche, Centre national de la recherche scientifique (CNRS)
Abdelhak El Amrani, MCF-Génomique Fonctionnelle
Texte intégral (1359 mots)

Les plantes et leur microbiote – tout comme les humains et leur microbiote –échangent du matériel génétique. En étudiant cette forme de communication entre les partenaires d’une symbiose, des scientifiques montrent comment les racines peuvent favoriser l’accès aux nitrates présents dans le sol – une ressource indispensable à la croissance des plantes. Ils et elles explorent aussi l’hypothèse que ce langage permette de lutter contre les pathogènes.
Depuis une dizaine d’années, une nouvelle vision des organismes s’impose. Les êtres humains, les animaux et les plantes ne peuvent exister sans leur association avec une myriade d’espèces de microorganismes qui constituent leur microbiote et qui leur apportent des fonctions biologiques complémentaires à leur hôte.
Par exemple, les champignons « mycorhiziens » prolongent les fonctions racinaires des plantes. Ils leur permettent notamment d’explorer le sol et ses ressources ; et apportent une fonction protectrice contre les pathogènes grâce à leur capacité à synthétiser des fongicides et des antibiotiques.
Cet ensemble « hôte et microbiote » forme ce que l’on appelle l’« holobionte », et il est maintenant admis qu’il s’agit d’une unité évolutive et fonctionnelle à prendre en compte dans son ensemble.
Cette nouvelle vision des organismes, non plus comme des individus uniques mais comme des métaorganismes, implique l’existence d’un dialogue entre les différents partenaires de cet ensemble complexe – que nous nous efforçons aujourd’hui de décoder.
Un nouveau langage, fondé sur le transfert de « code génétique » au sein des êtres vivants
Au sein des êtres vivants, différents mécanismes de communication sont connus, permettant le transfert d’informations à différentes échelles de l’organisme. Il peut s’agir d’échanges d’ions, comme le calcium ou le potassium entre les cellules, de signaux électriques à travers nos neurones ou encore le transport d’hormones dans le sang, comme l’insuline qui régule la glycémie en fonction de notre régime alimentaire.
Il existe même des petites protéines ou des peptides capables de voyager entre les organes, qui peuvent par exemple être impliqués dans l’immunité. Un cas très étudié est celui de la systémine, produite par les feuilles de plantes blessées. Ce peptide est transféré à d’autres organes pour induire des mécanismes de défense dans la plante entière.
En plus de cet arsenal de dialogues moléculaires, une autre voie de communication a été découverte en 1993 et a révolutionné le domaine de la communication chez les organismes vivants. Elle est basée sur l’échange de matériel génétique, composé de mini-séquences appelées « microARN », entre différentes cellules et/ou organes d’un même individu.
Initialement observée chez un nématode (un ver microscopique), cette découverte a ensuite été généralisée à d’autres animaux, aux êtres humains et aux plantes. Elle a donné lieu à l’attribution du prix Nobel de médecine 2024 à Victor Ambros et Gary Ruvkun.
Les premières recherches ont montré que ces microARN sont des intermédiaires de communication impliqués dans la majorité des processus biologiques, depuis l’embryogenèse jusqu’au vieillissement, et affecte notamment l’immunité et la résistance des organismes aux contraintes environnementales.
Un langage aussi utilisé entre différents êtres vivants
Depuis une dizaine d’années, nous savons également que ces microARN sont impliqués dans le transfert d’information entre différents individus – ce que l’on peut qualifier de communication.
En particulier, les microorganismes du microbiote et leur hôte échangent du matériel génétique. Ceci est particulièrement surprenant car, en général, le matériel génétique (ADN) ou l’intermédiaire de ce matériel (ARN) ne sont pas très mobiles entre cellules et a fortiori entre cellules d’individus et d’espèces différents !
Néanmoins, l’étude du microbiote intestinal des mammifères a bien mis en évidence en 2016 l’implication de microARN produits par les cellules épithéliales du tube digestif de l’hôte, dont le but est d’exercer une pression de sélection du microbiote intestinal bénéfique et de reprogrammer le fonctionnement de ce dernier.
De la même façon, nous avons montré que les racines des plantes influencent le fonctionnement de leur microbiote. Celui-ci, par son rôle dans l’assimilation des nutriments, présente des similitudes avec le système digestif des animaux.
Pourquoi ce « langage » est important pour une agriculture en transition
En 2024, nous avons également montré (Brevet FR3147485 du 11/10/2024) que des microARN de plantes pouvaient réduire la compétition de ses dernières avec certains microorganismes présents dans le sol à proximité de leurs racines pour l’accès aux nitrates, une ressource vitale pour les végétaux souvent apportée par les engrais minéraux ou les épandages de lisier et fumier.
De plus, dans le cas de certains stress environnementaux ou bien d’infections par les pathogènes, l’expression des microARN est perturbée et on assiste à un développement anarchique, ou déséquilibre, du microbiote – on parle de « dysbiose ».
Il est concevable d’agir sur le « langage » entre microbiote et racines pour moduler la réponse des plantes aux changements environnementaux, notamment en contexte agricole. Par exemple, l’utilisation de microARN naturellement produits par les plantes pourrait aider ces dernières à recruter un microbiote bénéfique, et leur permettre de se défendre des pathogènes, de résister aux stress environnementaux liés au changement climatique ou encore de faciliter leur nutrition ; ce qui pourrait permettre de limiter notre dépendance aux engrais minéraux et aux produits phytosanitaires délétères pour l’environnement.
Nous espérons que ces pratiques fondées sur l’application de microARN mimant ceux naturellement produits par les plantes puissent constituer une nouvelle porte d’entrée vers une agriculture durable et respectueuse de l’environnement sans avoir recours à l’introduction de gènes exogènes dans le génome des plantes, ce qui crée des organismes génétiquement modifiés, qui sont l’objet de controverses dans notre société.
Cécile Monard a reçu des financements de CNRS, CMI Roullier, OSERen
Abdelhak El amrani a reçu des financements de la région de bretagne, CNRS, Europe, ANR.
- GÉNÉRALISTES
- Ballast
- Fakir
- Interstices
- Issues
- Korii
- Lava
- La revue des médias
- Time [Fr]
- Mouais
- Multitudes
- Positivr
- Regards
- Slate
- Smolny
- Socialter
- UPMagazine
- Le Zéphyr
- Idées ‧ Politique ‧ A à F
- Accattone
- À Contretemps
- Alter-éditions
- Contre-Attaque
- Contretemps
- CQFD
- Comptoir (Le)
- Déferlante (La)
- Esprit
- Frustration
- Idées ‧ Politique ‧ i à z
- L'Intimiste
- Jef Klak
- Lignes de Crêtes
- NonFiction
- Nouveaux Cahiers du Socialisme
- Période
- ARTS
- L'Autre Quotidien
- Villa Albertine
- THINK-TANKS
- Fondation Copernic
- Institut La Boétie
- Institut Rousseau
- TECH
- Dans les algorithmes
- Framablog
- Gigawatts.fr
- Goodtech.info
- Quadrature du Net
- INTERNATIONAL
- Alencontre
- Alterinfos
- AlterQuebec
- CETRI
- ESSF
- Inprecor
- Journal des Alternatives
- Guitinews
- MULTILINGUES
- Kedistan
- Quatrième Internationale
- Viewpoint Magazine
- +972 mag
- PODCASTS
- Arrêt sur Images
- Le Diplo
- LSD
- Thinkerview
