11.01.2026 à 15:42
Groenland : rester avec les Inuit polaires
Texte intégral (2848 mots)
En juin 1951, l’explorateur Jean Malaurie voit surgir de la toundra une immense base militaire américaine, bâtie dans le secret le plus total. Ce choc marque pour lui le début d’un basculement irréversible pour les sociétés inuit. Aujourd’hui, alors que le Groenland redevient un enjeu stratégique mondial, l’histoire semble se répéter. Rester avec les Inuit polaires, c’est refuser de parler de territoires en oubliant ceux qui les habitent.
Le 16 juin 1951, l’explorateur français Jean Malaurie progresse en traîneaux à chiens sur la côte nord-ouest du Groenland. Il est parti seul, sur un coup de tête, avec un maigre pécule du CNRS, officiellement pour travailler sur les paysages périglaciaires. En réalité, cette rencontre avec des peuples dont la relation au monde était d’une autre nature allait forger un destin singulier.
Ce jour-là, après de longs mois d’isolement parmi les Inuit, au moment critique du dégel, Malaurie avance avec quelques chasseurs. Il est épuisé, sale, amaigri. L’un des Inuit lui touche l’épaule : « Takou, regarde » Un épais nuage jaune monte au ciel. À la longue-vue, Malaurie croit d’abord à un mirage : « une cité de hangars et de tentes, de tôles et d’aluminium, éblouissante au soleil dans la fumée et la poussière […] Il y a trois mois, la vallée était calme et vide d’hommes. J’avais planté ma tente, un jour clair de l’été dernier, dans une toundra fleurie et virginale. »
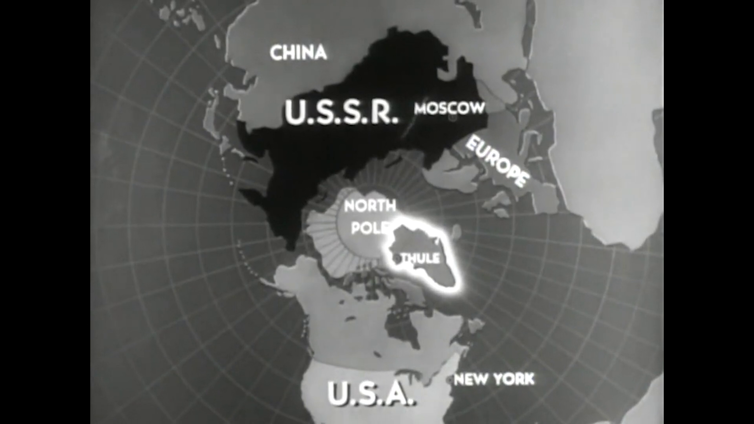
Le souffle de cette ville nouvelle, écrira-t-il, « ne nous lâchera plus ». Les excavatrices tentaculaires raclent la terre, les camions vomissent les gravats à la mer, les avions virevoltent. Malaurie est projeté de l’âge de pierre à l’âge de l’atome. Il vient de découvrir la base secrète américaine de Thulé, nom de code Operation Blue Jay. L’un des projets de construction militaire les plus massifs et les plus rapides de l’histoire des États-Unis.

Sous ce nom anodin se cache une logistique pharaonique. Les États-Unis redoutent une attaque nucléaire soviétique par la route polaire. En un seul été, quelque 120 navires et 12 000 hommes sont mobilisés dans une baie qui n’avait connu jusque-là que le glissement silencieux des kayaks. Le Groenland ne comptait alors qu’environ 23 000 habitants. En 104 jours, sur un sol gelé en permanence, surgit une cité technologique capable d’accueillir les bombardiers géants B-36, porteurs d’ogives nucléaires. À plus de 1 200 kilomètres au nord du cercle polaire, dans un secret presque total, les États-Unis font surgir l’une des plus grandes bases militaires jamais construites hors de leur territoire continental. Un accord de défense est signé avec le Danemark au printemps 1951, mais l’Operation Blue Jay est déjà engagée : la décision américaine a été prise dès 1950.
L’annexion de l’univers Inuit
Malaurie comprend aussitôt que la démesure de l’opération signe, de fait, une annexion de l’univers Inuit. Un monde fondé sur la vitesse, la machine, l’accumulation vient de pénétrer brutalement, aveuglément, un espace réglé par la tradition, le cycle, la chasse et l’attente.
Le geai bleu est un oiseau bruyant, agressif, extrêmement territorial. La base de Thulé se situe à mi-chemin entre Washington et Moscou par la route polaire. À l’heure des missiles hypersoniques intercontinentaux, hier soviétiques, aujourd’hui russes, c’est cette même géographie qui fonde encore l’argument du « besoin impérieux » invoqué par Donald Trump dans son désir d’annexion du Groenland.
Le résultat immédiat le plus tragique de l’Opération Blue Jay ne fut pas militaire, mais humain. En 1953, pour sécuriser le périmètre de la base et de ses radars, les autorités décidèrent de déplacer l’ensemble de la population inughuit locale vers Qaanaaq, à une centaine de kilomètres plus au nord. Le déplacement fut rapide, contraint, sans consultation, brisant le lien organique entre ce peuple et ses territoires de chasse ancestraux. Un “peuple racine” déraciné pour faire place à une piste d’aviation.
C’est sur ce moment de bascule foudroyante que Malaurie situe l’effondrement des sociétés traditionnelles inuit, où la chasse n’est pas une technique de survie mais un principe organisateur du monde social. L’univers inuit est une économie du sens, faite de relations, de gestes et de transmissions, qui donnent à chacun reconnaissance, rôle et place. Cette cohérence intime, qui fait la force de ces sociétés, les rend aussi extrêmement vulnérables lorsqu’un système extérieur en détruit soudainement les fondements territoriaux et symboliques.
Conséquences de l’effondrement des structures traditionnelles
Aujourd’hui, la société groenlandaise est largement sédentarisée et urbanisée. Plus du tiers des 56 500 habitants vit à Nuuk, la capitale, et la quasi-totalité de la population réside désormais dans des villes et localités côtières sédentarisées. L’habitat reflète cette transition brutale. Dans les grandes villes, une part importante de la population occupe des immeubles collectifs en béton, construits pour beaucoup dans les années 1960 et 1970, souvent vétustes et suroccupées. L’économie repose largement sur une pêche industrielle tournée vers l’exportation. La chasse et la pêche de subsistance persistent. Fusils modernes, GPS, motoneiges, connexions satellitaires accompagnent désormais les gestes anciens. La chasse demeure un repère identitaire, mais elle ne structure plus ni l’économie ni la transmission.
Les conséquences humaines de cette rupture sont massives. Le Groenland présente aujourd’hui l’un des taux de suicide les plus élevés au monde, en particulier chez les jeunes hommes inuit. Les indicateurs sociaux contemporains du Groenland - taux de suicide, alcoolisme, violences intrafamiliales – sont largement documentés. De nombreux travaux les relient à la rapidité des transformations sociales, à la sédentarisation et à la rupture des transmissions traditionnelles.

Revenons à Thulé. L’immense projet secret engagé au début des années 1950 n’avait rien de provisoire. Radars, pistes, tours radio, hôpital : Thulé devient une ville stratégique totale. Pour Malaurie, l’homme du harpon est condamné. Non par une faute morale, mais par une collision de systèmes. Il met en garde contre une européanisation qui ne serait qu’une civilisation de tôle émaillée, matériellement confortable, humainement appauvrie. Le danger n’est pas dans l’irruption de la modernité, mais dans l’avènement, sans transition, d’une modernité sans intériorité, opérant sur des terres habitées comme si elles étaient vierges, répétant, à cinq siècles d’écart, l’histoire coloniale des Amériques.
Espaces et contaminations radioactives
Le 21 janvier 1968, cette logique atteint un point de non-retour. Un bombardier B-52G de l’US Air Force, engagé dans une mission permanente d’alerte nucléaire du dispositif Chrome Dome, s’écrase sur la banquise à une dizaine de kilomètres de Thulé. Il transporte quatre bombes thermonucléaires. Les explosifs conventionnels des bombes nucléaires, destinés à amorcer la réaction, détonnent à l’impact. Il n’y a pas d’explosion nucléaire, mais la déflagration disperse sur une vaste zone du plutonium, de l’uranium, de l’americium et du tritium.
Dans les jours qui suivent, Washington et Copenhague lancent Project Crested Ice, une vaste opération de récupération et de décontamination avant la fonte printanière. Environ 1 500 travailleurs danois sont mobilisés pour racler la glace et collecter la neige contaminée. Plusieurs décennies plus tard, nombre d’entre eux engageront des procédures judiciaires, affirmant avoir travaillé sans information ni protection adéquates. Ces contentieux se prolongeront jusqu’en 2018-2019, débouchant sur des indemnisations politiques limitées, sans reconnaissance juridique de responsabilité. Aucune enquête épidémiologique exhaustive ne sera jamais menée auprès des populations inuit locales.
Aujourd’hui rebaptisée Pituffik Space Base, l’ancienne base de Thulé est l’un des nœuds stratégiques majeurs du dispositif militaire américain. Intégrée à la US Space Force, elle joue un rôle central dans l’alerte antimissile et la surveillance spatiale en Arctique, sous un régime de sécurité maximale. Elle n’est pas un vestige de la guerre froide, mais un pivot actif de la géopolitique contemporaine.
Dans Les Derniers Rois de Thulé, Malaurie montre que les peuples racine n’ont jamais de place possible au cœur des considérations stratégiques occidentales. Face aux grandes manœuvres du monde, l’existence des Inuit y devient aussi périphérique que celle des phoques ou des papillons.
Les déclarations de Donald Trump ne font pas surgir un monde nouveau. Elles visent à généraliser au Groenland un système en place depuis soixante-quinze ans. Mais la position d’un homme ne saurait nous exonérer de nos responsabilités collectives. Entendre aujourd’hui que le Groenland « appartient » au Danemark et dépend de l’OTAN, sans même évoquer les Inuit, revient à répéter un vieux geste colonial : concevoir les territoires en y effaçant ceux qui l’habitent.
Les Inuit demeurent invisibles et inaudibles. Nos sociétés continuent de se représenter comme des adultes face à des populations indigènes infantilisées. Leur savoir, leurs valeurs, leurs manières sont relégués au rang de variables secondaires. La différence n’entre pas dans les catégories à partir desquelles nos sociétés savent agir.
À la suite de Jean Malaurie, mes recherches abordent l’humain par ses marges. Qu’il s’agisse des sociétés de chasseurs-cueilleurs ou de ce qu’il reste de Néandertal, lorsqu’on le déshabille de nos projections, l’Autre demeure toujours l’angle mort de notre regard. Nous ne savons pas voir comment s’effondrent des mondes entiers lorsque la différence cesse d’être pensable.
Malaurie concluait son premier chapitre sur Thulé par ces mots :
« Rien n’aura été prévu pour imaginer l’avenir avec hauteur. »
Il faut redouter par-dessus tout non la disparition brutale d’un peuple, mais sa relégation silencieuse, et radicale, dans un monde qui parle de lui sans jamais le regarder ni l’entendre.
Ludovic Slimak ne travaille pas, ne conseille pas, ne possède pas de parts, ne reçoit pas de fonds d'une organisation qui pourrait tirer profit de cet article, et n'a déclaré aucune autre affiliation que son organisme de recherche.
07.01.2026 à 11:49
Éditer le génome pour soigner : où en sont les thérapies issues de CRISPR et ses dérivés ?
Texte intégral (1679 mots)
Ce qui ressemblait hier encore à de la science-fiction est désormais une réalité clinique : l’édition du génome humain avec CRISPR-Cas9 commence à guérir des maladies jusque-là incurables. Mais où en est réellement cette révolution annoncée ? Entre premiers succès cliniques, limites techniques et questions éthiques persistantes, les thérapies issues de CRISPR dessinent un paysage où promesses et prudence sont désormais indissociables.
Nous assistons à une nette montée des espoirs pour des maladies rares, souvent « orphelines ». Par exemple, un nourrisson atteint d’un déficit métabolique rare (une maladie génétique dans laquelle une enzyme ou une voie métabolique essentielle ne fonctionne pas correctement) dû à une mutation sur le gène CPS1, a reçu en 2025 un traitement « sur mesure » utilisant la technique d’édition de base (base editing), avec des résultats biologiques encourageants.
Aujourd’hui, l’édition génique n’est plus une hypothèse lointaine, mais donne des résultats concrets et change déjà la vie de certains patients. Pour comprendre ce qui est en train de se jouer, il faut revenir sur les progrès fulgurants de ces dernières années, des premiers essais pionniers aux versions de plus en plus sophistiquées de l’édition génomique.
Développée en 2012 grâce à l’association d’une endonucléase, Cas9, et de petits ARN guides (sgRNA), cette méthode d’édition ciblée du génome a bouleversé la biologie moderne, au point de valoir à ses inventrices le prix Nobel de chimie en 2020. Depuis son invention, le CRISPR-Cas9 classique est largement utilisé dans les laboratoires, dont le nôtre, pour créer des modèles cellulaires de maladies, fabriquer des cellules qui s’illuminent sous certaines conditions ou réagissent à des signaux précis, et explorer le rôle de gènes jusqu’ici mystérieux.
Un premier système extraordinaire mais imparfait
Côté clinique, l’utilisation de CRISPR-Cas9 a ouvert des possibilités thérapeutiques inédites : modifier précisément un gène, l’inactiver ou en corriger une version défectueuse, le tout avec une simplicité et une rapidité jusqu’alors inimaginables. Mais cette puissance s’accompagnait alors de limites importantes : une précision parfois imparfaite, avec des coupures hors-cible difficiles à anticiper (des modifications accidentelles de l’ADN réalisées à des endroits non prévus du génome), une efficacité variable selon les cellules, et l’impossibilité d’effectuer des modifications plus fines sans induire de cassure double brin (une rupture affectant les deux brins d’ADN à un site génomique spécifique) potentiellement délétère.
Ces limites tiennent en grande partie au recours obligatoire aux cassures double brin et à la réparation par homologie (mode de réparation de l’ADN dans lequel la cellule s’aide d’une séquence d’ADN modèle très similaire – ou fournie par le chercheur – pour réparer une cassure double brin), un mécanisme peu fiable et inégal selon les types cellulaires. Mais la véritable rupture est apparue à partir de 2016 avec l’invention des éditeurs de base (base editors), des versions ingénieusement modifiées de CRISPR capables de changer une seule lettre de l’ADN sans provoquer de cassure double brin. Pour la première fois, il devenait possible de réécrire le génome avec une précision quasi chirurgicale, ouvrant la voie à des corrections plus sûres et plus fines que celles permises par Cas9 classique. Cependant, les base editors restaient limités : ils permettaient d’effectuer certaines substitutions de bases, mais étaient incapables de réaliser des insertions ou des modifications plus complexes du génome.
Ces limitations des base editors ont été en partie levées avec l’arrivée de leurs successeurs, les prime editors, en 2019 : ces nouvelles machines moléculaires permettent non seulement de substituer des bases, mais aussi d’insérer ou de supprimer de courtes séquences (jusqu’à plusieurs kilobases), le tout sans provoquer de cassure double brin, offrant ainsi un contrôle beaucoup plus fin sur le génome. Cette technique a été utilisée avec succès pour créer en laboratoire des modèles cellulaires et animaux de maladies génétiques, et des plantes transgéniques. Cependant, en pratique, son efficacité restait trop faible pour des traitements humains, et le résultat dépendait du système de réparation de la cellule, souvent inactif ou aléatoire. Mais en six ans, la technique a gagné en précision et polyvalence, et les études chez l’animal ont confirmé à la fois son efficacité et la réduction des effets hors-cible. Résultat : en 2025, six ans après son invention, le prime editing fait enfin son entrée en clinique, un moment que beaucoup de médecins décrivent comme un véritable tournant pour la médecine.
Des traitements sur le marché
Dès 2019, de premiers essais cliniques avec le système CRISPR-Cas9 classique (le médicament Casgevy) avaient été réalisés sur des patients atteints de β-thalassémie et drépanocytose, deux maladies génétiques de l’hémoglobine, via la correction ex vivo et la réinjection des cellules modifiées au patient. Les premiers résultats étaient prometteurs : certains patients avaient vu leur production de globules rouges anormaux corrigée de manière durable, avec une amélioration significative de leurs symptômes, après une unique injection. Le traitement Casgevy a d’ailleurs été approuvé en Europe en 2024, pour un coût d’environ 2 millions d’euros par patient.
Plus récemment, en 2025 un bébé atteint d’une mutation du gène CPS1 a été guéri grâce à l’édition de base, la version moins invasive et plus sûre de CRISPR-Cas9, mais qui reste limitée aux substitutions ponctuelles et ne permet pas toutes les modifications (pas d’insertion de séquences longues). Mais aujourd’hui, le prime editing lève les deux grands verrous du CRISPR-Cas9 classique – la nécessité de casser l’ADN et la dépendance à des mécanismes de réparation inefficaces – ouvrant la voie à une édition plus sûre, plus précise et applicable à un spectre beaucoup plus large de maladies.
Il n’est plus limité à de simples conversions ponctuelles, mais permet pour la première fois de remplacer ou restaurer un gène complet, de façon précise et contrôlée. L’année 2025 marque le premier succès clinique d’une telle thérapie – une étape historique pour l’édition génomique. En effet, le 19 mai 2025 la société Prime Medicine fondée par David Liu, inventeur du prime editing, a annoncé la première administration humaine de sa thérapie, destinée à un jeune patient atteint de granulomatose chronique, une maladie immunitaire rare liée à une mutation de l’ADN. Les premiers résultats biologiques de ce « CRISPR ultrapuissant » se sont révélés très prometteurs, ouvrant une nouvelle ère pour l’édition génomique. Il faudra toutefois patienter encore quelques mois avant de mesurer réellement le succès du prime editing : les premiers essais cliniques restent très récents et le manque de recul ne permet pas encore d’en tirer des conclusions définitives, notamment en termes de sécurité – l’absence d’effets secondaires – et de stabilité à long terme.
Ces stratégies d’édition du génome s’inscrivent pleinement dans le mouvement de la médecine personnalisée, où chaque traitement est conçu sur mesure pour un patient donné, en fonction de sa mutation spécifique – un véritable médicament « pour lui seul ». Pour la suite, des sociétés annoncent déjà vouloir continuer l’aventure avec des stratégies consistant à administrer directement les traitements dans le corps, sans passer par la modification in vitro de cellules prélevées chez le patient – une procédure complexe et onéreuse.
D’un prototype de laboratoire, on est donc passés en un temps record à une technologie polyvalente, et on entre désormais dans l’ère de la médecine personnalisée même pour des pathologies très rares. Le champ d’application s’élargit : on ne se contente plus des pathologies sanguines – des essais et projets explorent des maladies métaboliques, des infections chroniques (ex. thérapies pour hépatite B) ou des maladies héréditaires rares. De nouvelles avancées viennent constamment enrichir le potentiel de CRISPR, élargissant sans cesse ses possibilités. Tous les types de maladies ne sont pas encore éligibles : les pathologies monogéniques (mutation simple, bien identifiée) sont les plus adaptées. Pour des maladies multifactorielles, complexes, ou dépendant de l’environnement, l’édition reste beaucoup moins directe. De plus, certaines cibles (cellules non accessibles, tissus spécifiques, traitement in vivo) restent techniquement très difficiles. C’est également un défi économique, tant les traitements de médecine personnalisée restent extrêmement coûteux.
Carole Arnold a reçu des financements de l'INSERM, la Région Grand-Est, le FEDER et l'ANR.
07.01.2026 à 11:49
Que sont les xénobots, ces robots biologiques qui bouleversent les frontières entre vivant et machine ?
Texte intégral (2918 mots)
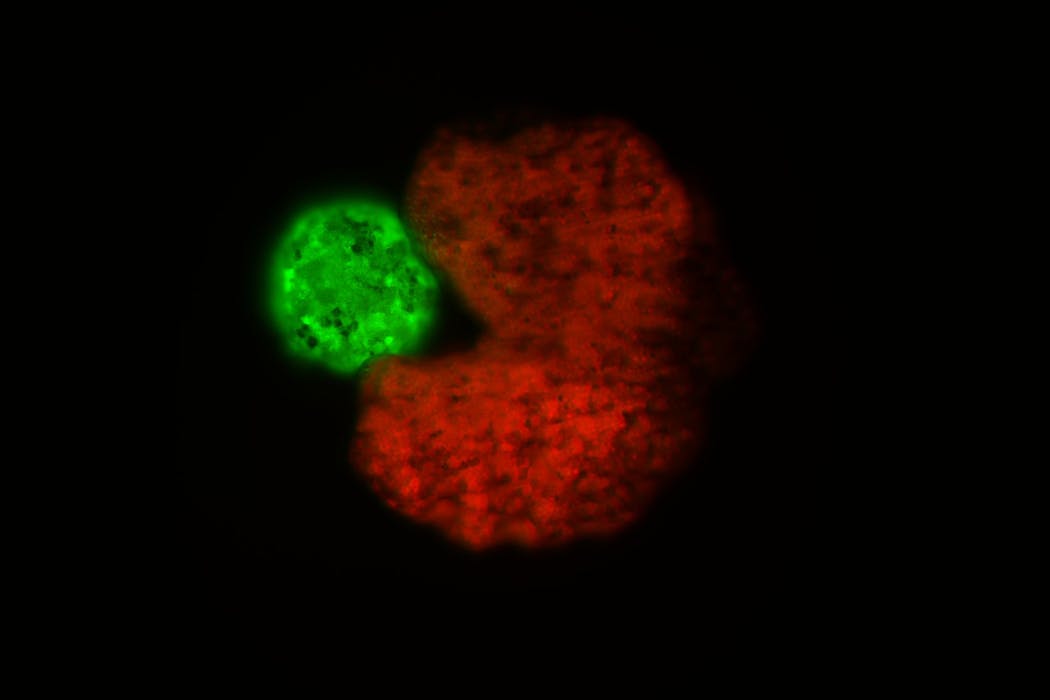
Les xénobots attirent aujourd’hui l’attention. Cette nouvelle catégorie de « robots vivants », fabriqués à partir de cellules d’amphibien et conçus grâce à des algorithmes, est capable de se déplacer, de se réparer et même, dans certaines expériences, de se reproduire en assemblant de nouveaux agrégats cellulaires. Ces entités questionnent la frontière entre machine et organisme. Des études récentes détaillent mieux leur fonctionnement moléculaire et ravivent les débats éthiques sur le contrôle de ces formes de vie programmables.
Les xénobots sont des entités biologiques artificielles entièrement composées de cellules vivantes issues d’embryons de xénope (Xenopus laevis), un amphibien africain. Prélevées sur des embryons de stade précoce, ces cellules sont encore indifférenciées : elles ne se sont pas encore spécialisées pour devenir des cellules de peau ou du foie par exemple. Elles sont cependant déjà « programmées » naturellement pour devenir des cellules qui tapissent les surfaces internes et externes du corps (peau, parois des organes, vaisseaux) ou des cellules contractiles du muscle cardiaque. Les contractions de ces cellules cardiaques agissent comme de minuscules moteurs, générant une propulsion, qui permet aux xénobots de se déplacer dans un milieu aquatique.
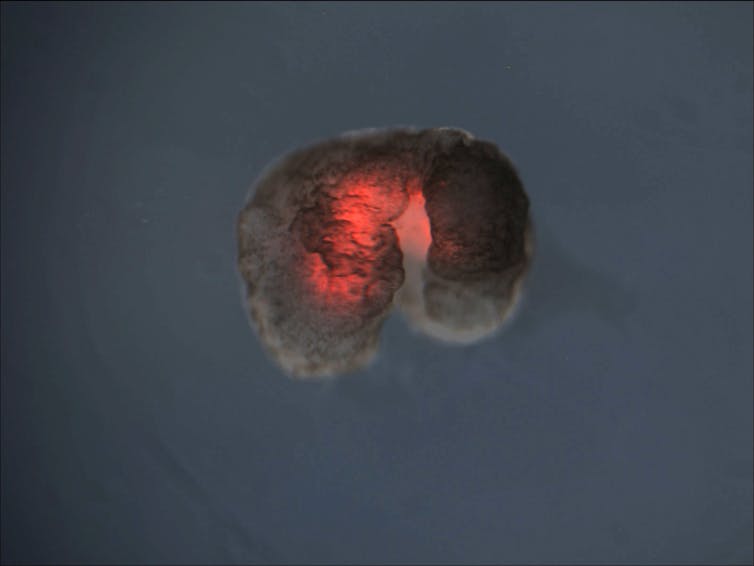
Pour fabriquer un xénobot, on isole et on assemble manuellement des groupes de cellules, comme des « briques biologiques ». À l’issue de cette phase de microchirurgie et d’organisation tridimensionnelle, les xénobots sont des entités de moins d’un millimètre de morphologies variables selon la fonction recherchée. Ils ne disposent d’aucun système nerveux ni organe sensoriel. Leur comportement est uniquement dicté par leur forme et leur composition cellulaire, toutes deux déterminées lors de leur création via des techniques de bio-ingénierie.
Bien qu’ils soient constitués uniquement de cellules vivantes, on parle de robots biologiques ou biobots, car ils obéissent à des tâches prédéfinies par l’humain : déplacement, coopération en essaim, transport d’objets, voire contrôle et assemblage d’autres xénobots à partir de cellules libres présentes autour d’eux (on parle d’autoréplication). Le terme « robot » prend ici un sens élargi, fondé sur la capacité à accomplir une tâche, en l’occurrence programmée par la forme et non par un logiciel interne.
Des robots biologiques conçus avec de l’IA
Avant de fabriquer un xénobot en laboratoire, des programmes d’intelligence artificielle (IA) sont utilisés pour tester virtuellement et simuler des milliers de formes et d’agencements cellulaires. Des algorithmes calculent quelles combinaisons fonctionneraient le mieux pour atteindre l’objectif fixé par le cahier des charges : par exemple, maximiser la vitesse de déplacement, transporter une charge ou induire de l’autoréplication.
Le lien entre l’intelligence artificielle et les cellules n’existe que lors de l’étape théorique de la conception. L’IA sert exclusivement à prédire et à optimiser la forme la plus adéquate, qui sera ensuite réalisée par microchirurgie et assemblage par des humains. Elle ne fournit aucun processus cognitif embarqué dans le xénobot, qui n’est donc pas contrôlé par une IA et ne possède aucune autonomie décisionnelle, contrairement à d’autres types de robots en développement.

Les xénobots ont d’abord été conçus sous forme de sphères, de triangles ou de pyramides, des géométries simples choisies pour être faciles à construire, afin d’étudier de manière contrôlée la manière dont la forme et la disposition des cellules influencent le mouvement.
La forme en croissant, dite Pac-Man, a été identifiée par intelligence artificielle comme la plus performante pour s’autorépliquer. La réplication est cependant limitée à trois ou quatre générations en laboratoire et les xénobots se dégradent après environ dix jours, limitant leurs applications à plus long terme.
Quelles applications pour les xénobots ?
Toutes les applications envisagées demeurent pour l’instant expérimentales. Certaines fonctions (locomotion, agrégation de particules, autoréparation, réplication limitée) ont été démontrées in vitro, ce qui constitue des preuves de concept. En revanche, les usages proposés en médecine ou pour l’environnement restent pour l’instant des hypothèses extrapolées à partir de ces expériences et de modèles informatiques, sans validation chez l’animal.
Dans le domaine environnemental, grâce à leur petite taille, leur forte biodégradabilité et leur capacité à fonctionner en essaim, les xénobots pourraient être utilisés pour concentrer des microparticules ou des polluants en un même endroit, avant une étape de récupération ou de traitement adaptée, les xénobots eux-mêmes se dégradant ensuite sans laisser de trace biologique.
Des versions plus complexes de xénobots pourraient être utilisées comme marqueurs visuels de modifications dans un environnement. Un tel xénobot, exposé à un certain type de polluant, subirait un changement de structure et de couleur. Cette propriété permettrait en quelque sorte de lire ce que le xénobot a rencontré dans son environnement, à l’image d’un capteur lumineux. Cette application n’a cependant pas encore été démontrée expérimentalement.

Dans le domaine médical, les xénobots pourraient être utilisés, tout comme d’autres microrobots, pour transporter localement des molécules thérapeutiques autour de cellules cibles, en réduisant ainsi la toxicité sur les tissus sains. La possibilité que les xénobots puissent servir à la livraison de molécules, comme des anticancéreux, reste cependant une extrapolation à partir d’expériences in vitro préliminaires sur d’autres microrobots.
Enfin, la recherche fondamentale pourrait bénéficier de l’existence de ces objets. L’organisation cellulaire des xénobots, hors du contexte embryonnaire, offre un modèle pour explorer la plasticité cellulaire ou tissulaire, la coordination cellulaire collective et l’auto-organisation, domaines clés pour comprendre l’évolution d’entités vivantes.
Des propriétés inattendues
Au-delà des tâches programmées, des propriétés remarquables ont été identifiées expérimentalement. Par exemple, des xénobots exposés à des vibrations sonores modifient significativement leur comportement moteur, passant d’une rotation à un déplacement linéaire rapide, une réaction absente chez les embryons de xénope au même stade.
En regroupant des cellules selon des architectures originales, les xénobots obligeraient ces cellules à reprogrammer en partie leur activité génétique : des analyses des gènes activés par ces cellules montrent l’activation de voies de stress, de réparation tissulaire ou de remodelage, qui ne sont pas utilisées de la même façon dans l’embryon intact.
De plus, dans ces expériences, plusieurs xénobots sectionnés se réparent spontanément et retrouvent un mouvement coordonné, ce qui suggère une communication à courte distance entre cellules, probablement via des signaux bioélectriques et chimiques, alors qu’aucun nerf n’est présent. Ces comportements illustrent une forte plasticité cellulaire, dont l’ampleur varie selon la manière dont les tissus ont été assemblés et les conditions de culture employées.
Derrière les promesses, des enjeux éthiques majeurs
Les promesses d’applications médicales ou environnementales ne doivent pas occulter l’ambiguïté de statut de ces entités, ni organismes naturels ni machines traditionnelles. Les xénobots sont des assemblages cellulaires conçus par l’humain appuyé par des systèmes d’intelligence artificielle. Leur déploiement reste, aujourd’hui, de l’ordre de l’hypothèse.
Plusieurs risques sont discutés par les bioéthiciens. Écologique d’abord, en cas d’acquisition par les xénobots d’une capacité de survie ou de réplication inattendue dans l’environnement. Sanitaire ensuite, en cas d’utilisation chez l’humain sans maîtrise complète de leur comportement à long terme. Un risque de détournement enfin, par exemple pour la libération ciblée d’agents toxiques.
À lire aussi : Xénobots, biobots : doit-on avoir peur des « robots vivants » ?
À cela s’ajoutent des enjeux plus symboliques : brouiller davantage la frontière entre vivant et non-vivant pourrait fragiliser certains cadres juridiques de protection du vivant, d’où les appels à un cadre réglementaire international spécifique à ces biorobots. Les promesses d’applications médicales ou dans le domaine de l’environnement ne doivent pas occulter l’ambiguïté de statut de ces entités, qui exigent une réflexion éthique et un cadre réglementaire international.
L’extension de l’utilisation de ces outils biologiques à des cellules humaines ne devra se réaliser que dans un cadre strictement contrôlé et sous supervision d’un comité éthique pluridisciplinaire. Plusieurs travaux dans ce domaine recommandent déjà des évaluations systématiques des risques (écologiques, sanitaires et de détournement), une transparence des protocoles et une implication du public dans les décisions de déploiement.
Il a été proposé de créer des instances spécifiques à cette technologie, chargées de vérifier la biodégradabilité, la limitation de la réplication, la traçabilité des essais et le respect de la dignité du vivant. Dans ce contexte, l’usage éventuel de xénobots ou d’organismes similaires dérivés de cellules humaines devrait s’inscrire dans un cadre réglementaire international inspiré de ces recommandations, avec des garde-fous comparables à ceux mis en place pour les organismes génétiquement modifiés (OGM) ou les thérapies géniques.
Jean-François Bodart ne travaille pas, ne conseille pas, ne possède pas de parts, ne reçoit pas de fonds d'une organisation qui pourrait tirer profit de cet article, et n'a déclaré aucune autre affiliation que son organisme de recherche.
